Principio de incertidumbre (indeterminación)
Fue formulado por Heisenberg a principios de siglo XX (1927) y, afirma que existen pares de propiedades del electrón
(partícula) que no pueden determinarse simultáneamente con precisión. Para el caso de una partícula que se mueve en la dirección del eje OX puede enunciarse como:
"Al efectuar simultáneamente la medida de la posición (x) y del momento lineal (p) de una partícula, el producto de las incertidumbres con las que se miden ambas magnitudes (Δx · Δp)
es mayor o igual que la constante de Planck (h) dividido por el factor (2π)”.
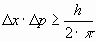
de modo que cuanto mayor sea la precisión con la que se mide la posición mayor será la imprecisión con la que se mide el momento.
Se puede concluir que el proceso de medida afecta a la magnitud medida.
El principio de incertidumbre puede justificarse a partir de las propiedades corpusculares y ondulatorias de las partículas.
Supongamos que pretendemos determinar la posición de un electrón. Para ello lo iluminamos con un haz de fotones y medimos la difusión de la luz producida por el electrón.
Imaginemos una situación ideal en la que iluminamos el electrón con un fotón de luz de una longitud de onda (λ) cuyo momento lineal tiene un valor de :
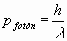
La mayor precisión se conseguiría cuando la longitud de onda del fotón fuera del orden del tamaño del electrón. Suponiendo que se pudiese reducir la longitud de onda del fotón al tamaño adecuado, esto llevaría consigo que el momento aumentaría.
El fotón impacta con el electrón, transmitiéndole parte o la totalidad de ese momento.
Por lo tanto, se introduce una indeterminación en la medida del
momento
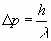
La incertidumbre en la medida de la posición del electrón podemos suponer que será del orden de la longitud de onda asociada,
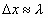
Así que, teniendo en cuenta ambas incertidumbres:
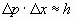
Así pues, al forzar la precisión en la medida de la posición, aumentamos la imprecisión en la medida del momento y viceversa.
El principio de incertidumbre aplicado a partículas o cuerpos de masa m que se mueven con una velocidad v se puede expresar:
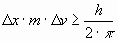
o bien:
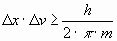
A medida que aumenta la masa, el producto de la indeterminación tiende a disminuir, llegando a valores muy pequeños cuando los valores de masa son del orden de las que se abordan en la Mecánica Clásica. Es por este motivo por el que, en estos casos, es posible medir ambas magnitudes con precisión.
Utilizando los datos del enunciado:
La imprecisión en la medida de la velocidad será:
Δv = (0,1%)· 30 = 0,03 m/s
La imprecisión en la medida de la posición será:
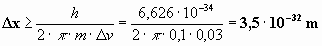
resultado muchísimo menor que el tamaño aproximado del núcleo
(del orden de 10-15 m).